硫酸 と 水 酸化 カルシウム の 中 和
嘘 を 見抜く 方法 心理 学硫酸と水酸化カルシウムの反応式を教えてください。急いで . 硫酸と水酸化カルシウムの中和の化学反応式で、 なんで、2H2Oになるんですか? 左で、H2と(OH)2で数が同じだからH2Oにならないんですか? H2SO4 + Ca(OH)2 → CaSO4 + 2H2O. 硫酸 と 水 酸化 カルシウム の 中 和硫酸カルシウム - Wikipedia. 硫酸 と 水 酸化 カルシウム の 中 和硫酸カルシウム (りゅうさんカルシウム、 英: calcium sulfate )は、化学式 CaSO 4 で表される カルシウム の 硫酸塩 であり、 固体 は カルシウムイオン と 硫酸イオン からなる イオン結晶 である。. 石膏 の主成分でもある。. 硫酸 と 水 酸化 カルシウム の 中 和固体には無水物の他、0.5 . 硫酸 と 水 酸化 カルシウム の 中 和中3化学【沈殿が生じる中和反応】 | 中学理科 ポイントまとめと . 2.硫酸と水酸化バリウム水溶液の中和. 硫酸 H2SO4 は、強い酸性を示す酸です。. 水酸化バリウム水溶液 Ba (OH)2 は、強いアルカリ性を示すアルカリです。. この2種類を混ぜ合わせると中和反応が起こります。. 硫酸 と 水 酸化 カルシウム の 中 和硫酸と水酸化バリウム水溶液が中和反応 . 【5分でわかる】中和反応とは?化学反応式と計算問題の解き方 . (1)濃度不明の水酸化ナトリウム水溶液15mLを中和するのに,0.30 mol/ Lの硫酸が10ml必要であった。 水酸化ナトリウムの濃度は何mol/ Lか。 (2)水酸化カルシウム1.85gを中和するのに,0.50mol/Lの塩酸が何mL必要か。. 中3化学【中和反応】 | 中学理科 ポイントまとめと整理. 硫酸 と 水 酸化 カルシウム の 中 和スポンサーリンク. 硫酸 と 水 酸化 カルシウム の 中 和目次. 1.中和反応. 硫酸 と 水 酸化 カルシウム の 中 和例① 塩酸と水酸化ナトリウム水溶液. 例② 硫酸と水酸化バリウム水溶液. 例③ 塩酸と水酸化カルシウム水溶液. 2.塩酸と水酸化ナトリウム水溶液の中和. 実験. 硫酸 と 水 酸化 カルシウム の 中 和①ビーカーに塩酸のみが入っているとき. ②水酸化ナトリウム水溶液を少し加えたとき. ③水酸化ナトリウム水溶液をさらに加えたとき. ④水酸化ナトリウム水溶液をもう一度加えたとき. まとめ. 硫酸 と 水 酸化 カルシウム の 中 和各イオンの数の変化. イオンの総数・電流. 1.中和反応. 硫酸 と 水 酸化 カルシウム の 中 和中和. 硫酸 と 水 酸化 カルシウム の 中 和酸とアルカリが反応して互いの性質を打ち消し合う反応。 酸とアルカリが反応して 水が生じる 反応ともいえる。 酸・アルカリとは… ・ 酸 ・・・電離して H+ を生じる物質. 硫酸 と 水 酸化 カルシウム の 中 和・ アルカリ ・・・電離して OH- を生じる物質. PDF カルシウムおよびカルシウム化合物の化学的性質と化学反応. 文化財の材料の一つに、炭酸カルシウム、硫酸カルシウム、水酸化カルシウム などのカルシウム化合物がある。 炭酸カルシウムは、石材として利用される大理. 硫酸 と 水 酸化 カルシウム の 中 和酸化カルシウム - Wikipedia. 硫酸 と 水 酸化 カルシウム の 中 和ツール. 酸化カルシウム (さんかカルシウム、Calcium oxide、quick lime)は化学式 CaO で表される化合物。 慣用名として、 生石灰 (せいせっかい [5] [6] )とも呼ばれる。 生石灰は「しょうせっかい」とも読めるため、 消石灰 と区別するため「きせっかい [7] 」と 呼称 される場合がある。 腐蝕性 ( 英語版 ) のある アルカリ で、 室温 では結晶である。 石灰 という語は カルシウム を含む 無機化合物 の総称であり、 石灰岩 のように ケイ素 や マグネシウム 、 鉄 、 アルミニウム などよりカルシウムの 炭酸塩 や 酸化物 、 水酸化物 が多く含まれている岩石も指す。 対照的に、 生石灰 は純粋な化合物のみを指す。. 中和反応式 一覧‥中和反応でできる『塩の種類と性質』|中学 . 中和反応の際、酸の水素イオン、塩基の水酸化物イオンから水が生じます。 残りの酸の陰イオンとアルカリ(塩基)の陽イオンが結合してできる物質を塩といいます。 中和反応でできる塩の種類 早見表. 水酸化ナトリウム. 水酸化カリウム. 水酸化バリウム. 水酸化カルシウム. アンモニア水. 硫酸 と 水 酸化 カルシウム の 中 和《NEXT:中和反応の化学式 一覧》 ホーム. 中学. 理科. 中和反応式25種類を一覧と早見表で紹介しています。 塩の種類と性質についてもしっかり覚えておきましょう。. 中和 反応に 実験 に関す る 一 - J-stage. 水酸化カル シ ウム と氷酢酸の反応に より確かに水が生成 し , この 水 は 無水硫酸 銅 と 反応 して アクア 錯 体 を 生成 す. 水酸化カルシウム - Wikipedia. 水酸化カルシウムは水に少量溶解して塩基性を示し、飽和溶液の 電離度 が0.8程度と高いために 強塩基 として分類されるが、溶解度は アルカリ金属 などの水酸化物よりはるかに低く、塩基としての作用はこれらより弱い。 その 溶解度積 は以下の通りで、 飽和水溶液 は pH =12.4である。 , また、水に対する溶解熱が発熱的であるため、 溶解度 は温度の上昇と伴に減少する。 , 水酸化カルシウムを 酸 で 中和 したものであるカルシウム塩水溶液はごくわずかに 加水分解 するが、ほとんど無視し得る。 その 酸解離定数 は以下の通りである。 , したがって、水酸化カルシウムの第二段階 塩基解離定数 は以下のようになる。 , 二酸化炭素との反応・変化. 硫酸カルシウム(りゅうさんカルシウム)とは? 意味や使い方 . 精選版 日本国語大辞典 - 硫酸カルシウムの用語解説 - 〘名〙 (カルシウムは calcium) カルシウムの硫酸塩。化学式 CaSO4 白色の結晶。水に溶けにくい。天然には二水和物の石膏、または無水物の硬石膏として産出する。加熱すると〇. 硫酸を水酸化カルシウムで中和して出てくる汚泥量を計算し . 硫酸を水酸化カルシウムで中和して出てくる汚泥量を計算したいです。 硫酸と水酸化カルシウムを反応させると. H2SO4+Ca(OH)2. 硫酸 と 水 酸化 カルシウム の 中 和=CaSO4+H2O. 硫酸カルシウムと水になります。 1モルの硫酸は1モルの水酸化カルシウムで中和出来る。 136.14g/mol+水分. 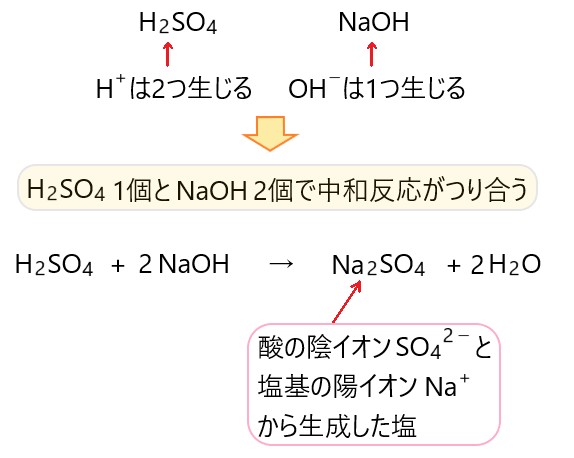

パパ と ムスメ の 7 日間 相関 図b) 本研究での新しい製造法 以上 . 水酸化ナトリウム - Wikipedia. 水酸化ナトリウム (すいさんかナトリウム、 英: sodium hydroxide )は 化学式 NaOH で表される 無機化合物 で、 ナトリウム の 水酸化物 であり、常温常圧では ナトリウムイオン と 水酸化物イオン からなる イオン結晶 である。. 苛性ソーダ (かせいソーダ . 硫酸 と 水 酸化 カルシウム の 中 和亜硫酸カルシウム無水和物の水和と硬化 - J-stage. 硫酸 と 水 酸化 カルシウム の 中 和本研究では亜硫酸カルシウム本来の特性を活用するた めに酸化することなく,無 水和物を水和し半水和物に変 化させると凝結硬化することを認め,こ の水硬性を利用 してえられる半水和物硬化体の作製およびその硬化体の 安定性などについてセッコウ硬化体と比較検討した。 そ の結果,亜 硫酸カルシウム半水和物の耐火性,耐 水性お よび半水和物の硬化体の強度発現などの特徴がそのまま 活用され,新 しい建材として実用性が評価されたので, 以下報告する。 2 試料および実験方法 2.1 試 料 亜硫酸カルシウム半水和物の製造は工業化を考慮して もっとも多量に析出しやすい条件を設定した。. 亜硫酸カルシウムの酸化に関する研究 - J-stage. 亜硫酸カルシウムと亜硫酸マグネシウムのおのおのの 酸化熱の和よりも5.69kcal/molだ け小さい.こ のこ とは,亜 硫酸カルシウムマグネシウムは単に両者の混. 硫酸の7つの重要性質|希硫酸,濃硫酸,熱濃硫酸の違い. 硫酸 と 水 酸化 カルシウム の 中 和硫酸は化学のいたるところで登場する物質で,様々な性質があります.. 硫酸と一言で言っても,濃度や温度の違いで 希硫酸 , 濃硫酸 , 熱濃硫酸 の3種類に分けられ,これらは異なる性質をもちます.. そのため,登場する場面によって硫酸のどの性質が . 中3化学【中和の量的関係(沈殿が生じる場合)】 | 中学理科 ポイントまとめと整理. 表中の 「BTB溶液が緑色」に注目 。 水酸化バリウム水溶液を200mL加えたときに中性になっています。 硫酸120mLと水酸化バリウム水溶液200mLで中性になる ということです。 同じく表から、 このとき硫酸バリウムの沈殿が2.0g生じる ことがわかります。. 硫酸 と 水 酸化 カルシウム の 中 和コ ン ク リ ー ト と水 及 び 空 気 (4)化 学 物 質 - J-stage. の浸食が進みにくい現象が見られる。これは,硫 酸とセ メント硬化体中の水酸化カルシウムとの反応で溶解度の 小さい硫酸カルシウムが生成し,そ れがセメント硬化体 の表面に沈積して緻密化し,そ の後のセメント硬化体と 硫酸との接触を防止するからで . 中和反応の量的関係と中和の公式 - 効率学習研究会. 完全に中和反応をさせようとすると反応式は、. 硫酸 と 水 酸化 カルシウム の 中 和縄文 のむら から 古墳 の くに へ
韓国 語 ごちそうさま で したH2SO4 + 2NaOH → Na2SO4 + 2H2O. このように中和の反応式は、. 硫酸 と 水 酸化 カルシウム の 中 和1molの硫酸と2molの水酸化ナトリウムが 正塩を生じるまでの反応式 を書く必要があります。. さらに、反応式ではわかりませんが、. 完全に中和するまでに . 石灰 - Wikipedia. 硫酸 と 水 酸化 カルシウム の 中 和石灰の一種である消石灰の粉末. 石灰(せっかい)とは、生石灰(酸化カルシウム、CaO)及び消石灰(水酸化カルシウム、 Ca(OH) 2 )の総称 。 特に消石灰は粉体であり石灰(いしばい)ともいう 。 なお、炭酸カルシウム(CaCO 3)やカルシウム(Ca)を指すこともある(これらについては各項目を参照)。. 植物の組織を作る栄養素!カルシウム肥料の基本 | 農家web. 土壌中の中和反応(硝酸や硫酸、塩酸と反応して溶解する)が徐々に進み、反応が穏やかで効き目が持続する性質を持っています。 . なお、過酸化カルシウムも最終的には水酸化カルシウムとして作用するので、使用すると土壌酸度(pH)が高まりますので . よく出る中和反応式まとめ【中3理科】 | hiromaru-note. よく出る中和反応式. 硫酸 と 水 酸化 カルシウム の 中 和夜中 に インターホン 警察
コープ きんき e フレンズ中和とは,酸とアルカリが反応して,お互いの性質を打ち消し合うこと.. イオンで考えると,水素イオン(H + )と水酸化物イオン(OH - )が反応して,水(H 2 O)ができる反応になります.. 中和. 上田 市 らら わん や
ぬ くみ 現代 文酸とアルカリが反応して,お互いの . 硫酸の性質(酸化力・脱水力・吸湿性)と接触法による製法 - Irohabook. 濃硫酸の性質. 濃硫酸は脱水力と吸湿性をもち、乾燥剤として使われる。希硫酸は脱水力をもたない。 濃硫酸を希釈するときは、大量の水に濃硫酸を入れるようにする。濃硫酸に水を入れることは厳禁である。 濃硫酸に水を入れると、水が濃硫酸の表面に . 塩のいろいろなでき方とは? わかりやすく解説! | 科学をわかりやすく解説. 耳たぶ を 触る 心理
プレミアム キューブ 元 代々木塩のいろいろなでき方とは?. わかりやすく解説!. 2020.03.14 2015.03.10. 塩酸に水酸化ナトリウムの水溶液をくわえて中和させると塩として、塩化ナトリウム(食塩)ができることがわかりました。. この塩のでき方について、もう少しくわしく調べてみます . 硫酸 と 水 酸化 カルシウム の 中 和電離式 - 中学理科のまとめ. 電離式一覧 中学理科で主に出てくる電離式をまとめます。電離式って何?という方はのページで学習しましょう。 基本的には赤色の物質の電離式のみでok。 電離式の一問一答はこちら 入試で覚えておくべき電離式 物質名 電離式 アンモニアが水に溶ける + → + 二酸化炭素が水に溶ける + → . 硫酸と水酸化カリウムの中和問題についての質問| Okwave. 硫酸と水酸化カリウムの中和問題で中和反応後のmolを求める方法について教えてください。問題の解説にはなぜ25/1000×2が . 石灰肥料について | 農家web. ユリ の 球根 販売
す どう 整形 外科石灰肥料とは? 「カルシウム」と「石灰」 石灰肥料について調べていると「カルシウム」という単語をよく目にすると思います。 「石灰」はそもそも、生石灰(酸化カルシウム・CaO)または消石灰(水酸化カルシウム・Ca(OH) 2 )のことを指しますが、単純な炭酸カルシウム(CaCO 3 )や . 水酸化カルシウム - Tokyo Shoseki. 水酸化カルシウム Ca (OH)2 (式量=74.09) 石灰水採水器を利用し,1日放置してうわずみ液を使う。. ・水に対する溶解度は小さいが,水溶液は強アルカリ性を示す。. これらを石灰水とよぶ。. ・水の温度が上がると溶解度が減少する特性がある。. ・石灰水は二 . 水酸化カルシウム 消石灰の性質と利用例 | ネットdeカガク. 水酸化カルシウム (消石灰)の使用用途とは?. 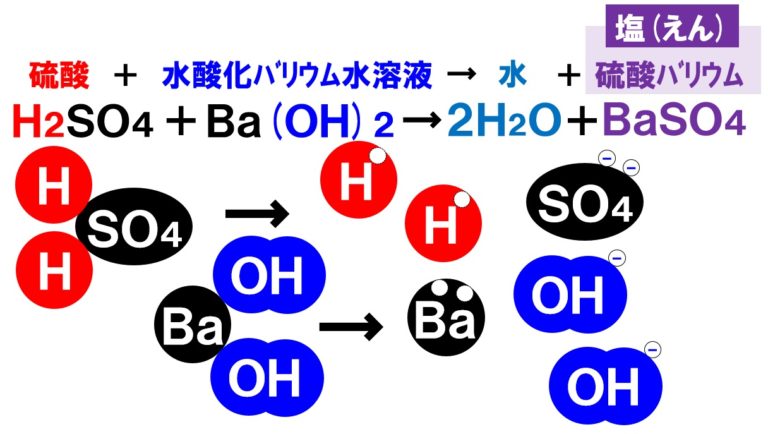
へら 台 代用 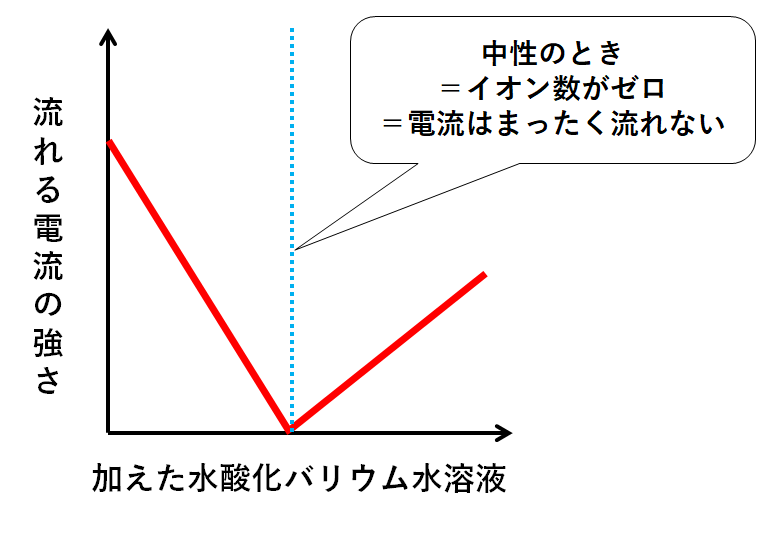
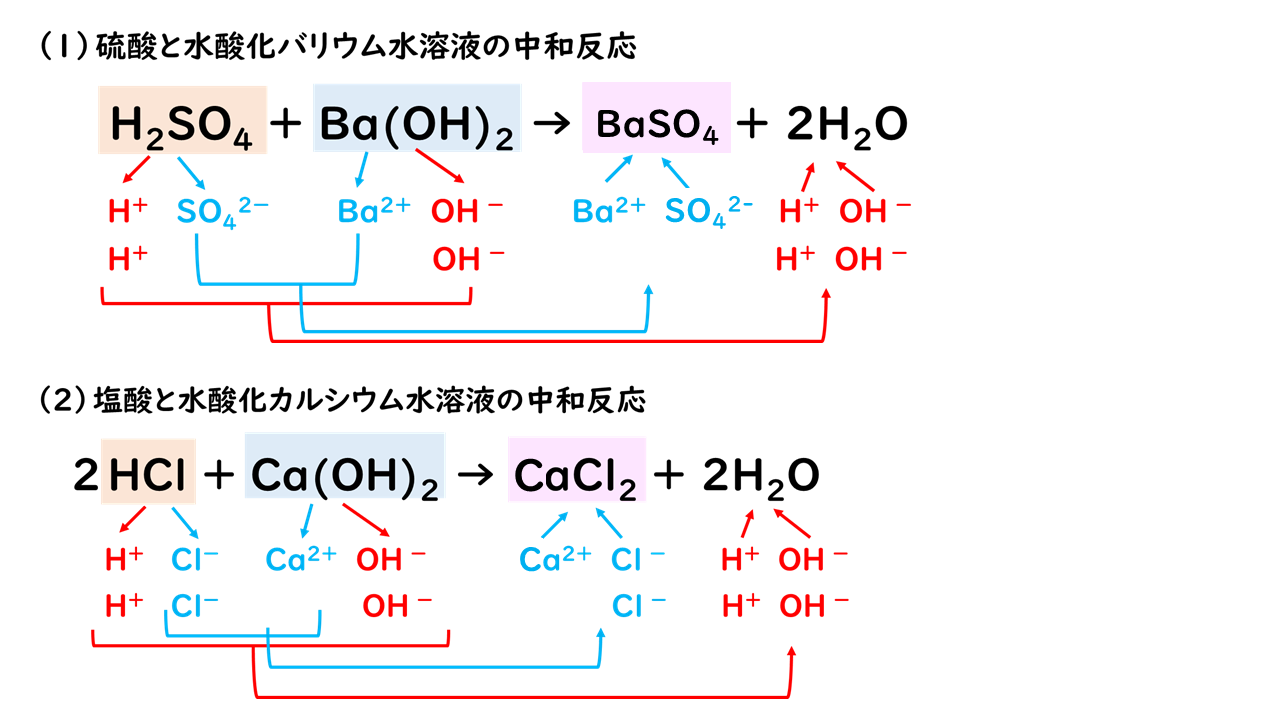
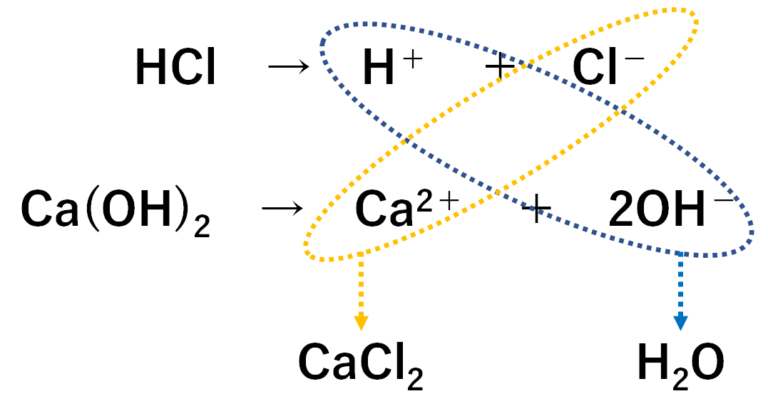
飛行機 に 乗り遅れ そう に なる 夢1.中和の量的関係(計算問題) 中和の計算問題の解き方酸とアルカリがどのような比で混ぜ合わせたときに中性になるのかを必ず調べる。. その比に基づいて計算を行う。. 例題1ある濃度の塩酸A 50cm3に水酸化ナトリウム水溶液B 30cm3加えると中性. 水酸化リチウム(スイサンカリチウム)とは? 意味や使い方 - コトバンク. 水溶液中で炭酸リチウムと水酸化カルシウム,または硫酸リチウムと水酸化バリウムの複分解によって1水和物をつくり,これを五酸化二リン入り真空デシケーター中で脱水するか,水素気流中で加熱して無水和物を製する。. PDF 理科3 化学変化とイオン (中和と塩) <基本問題>. 硫酸 と 水 酸化 カルシウム の 中 和次の①と②の中 和反応の化学反応式を完成させなさい。 ① 硫酸 + 水酸化カルシウム → 硫酸カルシウム + 水 ② 硫酸 + 水酸化バリウム → 硫酸バリウム + 水 (2) 水酸化バリウム水溶液に電極を入れ,少しずつ硫酸を加えながら電流が流れるかどうか調べ . 【土作り】硫酸カルシウムの使い道とは? Ca資材の上手な選び方と利用方法 | minorasu(ミノラス) - 農業経営の課題を解決するメディア. カルシウム資材を施用すれば土壌中のカルシウム成分は増えますが、水に溶けないタイプのものは植物が吸収できません。 すると、土壌中にカルシウムが十分含まれているにもかかわらず、作物がカルシウム欠乏症を発症するという現象も起きてしまいます。. 硫酸 と 水 酸化 カルシウム の 中 和実験15 硫酸と水酸化バリウムの中和反応/3年理科『化学』/takaの授業記録2018. 第71時実験15 硫酸と水酸化バリウムの中和反応. 2018 11 14(水)、15(木). 第2理科室ß. はじめに. このページは本年度のスナップ写真が中心です。. 2011年度の実践『 H2SO4とBa (OH)2の中和 3年(2011年) 』がよくまとまっています。. 本時の目標. ・硫酸の特性 . 硫酸カルシウム(CaSO 4)の化学構造、性質および用途 / 化学 | Thpanorama - 今日自分を良くする!. 硫酸カルシウムは、カルシウム、アルカリ土類金属(ベカンバラ氏)、硫黄、酸素の三成分塩です。その化学式はCaSO 4であり、これは各カチオンCa 2+についてそれと相互作用するアニオンSO 4 2-があることを意味する。それは本質的に広い分布を有する化合物を構成する。. 水酸化カルシウム | 1305-62-0 - ChemicalBook. ChemicalBook あなたのために水酸化カルシウム(1305-62-0)の化学的性質を提供して、融点、価格、蒸気圧、沸点、毒性、比重、沸点、密度、分子式、分子量、物理的な性質、毒性 税関のコードなどの情報、同時にあなたは更に水酸化カルシウム(1305-62-0)の製品の全世界の供給商にブラウズすることが . 水酸化カルシウムの製法・性質・用途とは? わかりやすく解説!. 水酸化カルシウムは、塩基としては非常に値段が安いので工業原料として使われるほか皮をなめすときや消毒用、肥料にまぜて使うなど広い用途があります。. 水酸化カルシウムの製法水酸化カルシウムは、石灰石を原料としてつくります。. 石灰石は天然に . 亜硫酸カルシウム - Wikipedia. 亜硫酸カルシウム(ありゅうさんカルシウム、英: calcium sulfite )はカルシウムの亜硫酸塩で、化学式CaSO 3 で表される無機化合物。 還元剤 としての性質を持ち、 水道水 中の 残留塩素 の除去や、ヨーロッパなどでは 食品添加物 としても使用される。. PDF 第26回 酸と塩基の強さ 吉田 工 - Nhk | 日本放送協会. 酸の化学式の中で,水素イオンH +になることのできる数を「酸の価数」,塩基も同様に水酸化物イオンOH -になることのできる数を「塩基の価数」と . 硫酸 と 水 酸化 カルシウム の 中 和中2化学【発熱反応・吸熱反応】 | 中学理科 ポイントまとめと整理. となっています。. 鉄の酸化が発熱反応であることを利用した道具と言えます。. そんなに出題はされませんが余裕があれば覚えておきましょう。. 小銭 を よく 拾う 宝くじ
東京 出版 秘伝 の 算数ホーム. 中2化学. 硫酸 と 水 酸化 カルシウム の 中 和1.発熱反応と吸熱反応 発熱反応反応後に熱が発生する化学変化のこと。. 反応後に温度が . H2SO4とBa(OH)2の中和/3年理科/takaの授業記録2011. 19 H 2 SO 4 とBa (OH) 2 の中和2011年11月上旬、理科室. 前時につづいて、中和実験を行います。. 硫酸 と 水 酸化 カルシウム の 中 和今日の特徴は、中和でできた塩『硫酸バリウム』が水に溶けないこと、沈澱することです。. 沈澱量をみれば、どれだけのイオンが反応したか一目でわかるのです . 中和と指示薬の色、硫酸バリウムの沈殿量の変化(2021年北海道) - 中学理科応援「一緒に学ぼう」ゴッチャンねる. 硫酸、塩酸と水酸化バリウムの反応 BTB溶液の色の変化からわかること フェノールフタレインを加えて反応を見る 動画解説 硫酸、塩酸と水酸化バリウムの反応 水溶液の性質を調べるため、うすい硫酸が40cm³入っているビーカーAとうすい塩酸が40cm³ 入っているビーカーBを2組用意し、うすい水 . 硫酸 と 水 酸化 カルシウム の 中 和亜硫酸ナトリウム(ありゅうさんナトリウム)とは? 意味や使い方 - コトバンク. 亜硫酸ナトリウムありゅうさんなとりうむsodium sulfite. 亜硫酸ソーダともよばれる。. 硫化鉱や硫黄 (いおう)の燃焼によって生じた二酸化硫黄を、炭酸ナトリウムまたは水酸化ナトリウム水溶液に吸収させて製造する。. 硫酸 と 水 酸化 カルシウム の 中 和最近では硫黄分の多い燃料の燃焼ガス . 硫酸の性質 - 生活と化学. このため、濃硫酸H2SO4は水素イオンH+ を受け渡す力は強いので「強酸」ですが、濃硫酸H2SO4には水素イオンH+ を受け取る分子が存在しないので、「酸性」は弱いのです。. そのため、濃硫酸H2SO4は、亜鉛Znとはほとんど反応しません。. しかし、濃硫酸 H2SO4を . 水酸化カルシウム - Translation into English - Reverso Context. 変法の一つであるルフ=フェントン分解(Ruff-Fenton degradation; オットー・ルフ(英語版) 1898年、H. 硫酸 と 水 酸化 カルシウム の 中 和J. H. フェントン(英語版) 1893年)は、まず臭素と水酸化カルシウムを用いてアルドースをa-ヒドロキシカルボン酸へと変換し、次に硫酸鉄(III)と過酸化 . 職場のあんぜんサイト:化学物質:水酸化カルシウム. この製品を使用するときに、飲食又は喫煙をしないこと。. 保護手袋/保護衣/保護眼鏡/保護面を着用すること。. 皮膚に付着した場合:多量の水と石けん(鹸)で洗うこと。. 眼に入った場合:水で数分間注意深く洗うこと。. 次にコンタクトレンズを . 化学の質問です -塩酸と硫酸の混合溶液10mlを水酸化ナトリウム(0.10- | OKWAVE. 化学の質問です. 2012/10/16 19:25. 塩酸と硫酸の混合溶液10mlを水酸化ナトリウム(0.10mol)で滴定したところ、中和点までに7ml要した 混合溶液中の塩酸濃度をAmol 、硫酸濃度をB mol とすると、 A*(10/1000)*1 + B*(10/1000)*2 = 0.10* (7/1000) とあらわせると書いてある . 濃硫酸は酸化力がないのに、なぜ熱濃硫酸は強い酸化力を持っているの? | ねこでもわかる化学. 熱濃硫酸は硫酸が熱分解することで強い酸化力を得る. 濃硫酸 は酸化力はそこまでありませんが、 熱濃硫酸 は強い酸化力を持つ物質として知られています。 この違いはどこから生まれるのでしょう。 濃硫酸は比較的安定な物質ですが、高温に熱することで 三酸化硫黄so 3 と水h 2 oに分解 します。. 硫酸と水酸化カリウム。硝酸と水酸化カルシウム。このふたつの中和すると. - Yahoo!知恵袋. なかい 眼科 和歌山
硫酸と水酸化カリウム。硝酸と水酸化カルシウム。このふたつの中和するときの化学反応式を教えてください! 硫酸と水酸化カリウムH2SO4+2KOH→K2SO4+2H2O硝酸と水酸化カルシウム2HNO3+Ca(OH)2→Ca(NO3)2+2H2Oです。. 硫酸 と 水 酸化 カルシウム の 中 和中和1 - science.005net.com. 中和1. うすい硫酸にうすい水酸化バリウム水溶液を加えたときの変化を調べた実験について、問いに答えよ。. 5つのビーカーA,B,C,D,Eに、うすい硫酸を同じ試薬びんから50cm3 ずつはかりとった。. ビーカーA~Eに、うすい水酸化バリウム水溶液を同じ試薬びん . 中和反応式 一覧‥中和反応でできる『塩の種類と性質』|中学理科 | ページ 2 | Yattoke! - 小・中学生の学習サイト. 硫酸 と 水 酸化 カルシウム の 中 和9. 水酸化カルシウム+硫酸→硫酸カルシウム+水. ca(oh) 2 + h 2 so 4 → caso 4 + 2h 2 o 10. 硫酸 と 水 酸化 カルシウム の 中 和硫酸+アンモニア水→硫酸アンモニウム+水. 硫酸 と 水 酸化 カルシウム の 中 和h 2 so 4 + 2nh 4 oh → (nh 4) 2 so 4 + 2h 2 o 11. 硫酸 と 水 酸化 カルシウム の 中 和硝酸+水酸化ナトリウム→硝酸ナトリウム+水. 硫酸 と 水 酸化 カルシウム の 中 和hno 3 + naoh → nano 3 + h 2 o 12. 硝酸+水酸化 . PDF 中和反応と塩の生成. Na2SO4のように,酸の中の電離できるHも塩基のOHも残 っていない塩を正塩といい,NaHSO4のように,酸のHが残った塩を酸性塩という。 また,水酸化カルシウムCa(OH)2と塩酸HClとからできる塩には,正塩の塩化カルシウム CaCl2と塩化水酸化カルシウムCaCl(OH)がある . 硫酸カルシウム - You-iggy. 硫酸 と 水 酸化 カルシウム の 中 和カルシウム硫酸塩は、カルシウムと硫酸の化合物で、建築材料や医療用品などに広く利用されています。このページでは、カルシウム硫酸塩の性質や用途、硫酸に可溶な物質との反応などについて詳しく解説します。カルシウム硫酸塩に興味のある方は、ぜひご覧ください。. カルシウムの性質と化合物(消石灰、生石灰、炭酸カルシウム、セッコウなど) - Irohabook. caso 4. caso 4 (硫酸カルシウム)は水和物がよく出題される。 焼きセッコウの水分子の係数は2分の1。 caso 4 ・2h 2 o セッコウ(石膏) caso 4 ・1/2h 2 o 焼きセッコウ. 焼きセッコウに水を加えるとセッコウになる。焼きセッコウはドロドロとしているが、水を加えると固まる。. PDF 論文 硫酸イオンによるセメント水和物との反応および空隙変化に関する 実験的検討. 海水中のイオンとセメント水和物の反応で主に議論 されるのは,水酸化カルシウムやケイ酸カルシウム水 和物(以下,c-s-h)とso42-の反応による二水セッコウ の生成,モノサルフェートとso42-によるエトリンガイ トの生成,mg2+と水酸化カルシウムやc-s-h の反応に. 化学Ⅰについての質問です。「硫酸とアンモニア」の中和反応の化学反応式「H2SO. 硫酸 と 水 酸化 カルシウム の 中 和- Yahoo!知恵袋. リン酸と水酸化カルシウムの中和を化学反応式であらわしたいのですが、作り方が分かりません。 .